이플루오린화 제논
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
이플루오린화 제논은 Xe-F 결합을 가진 선형 분자 구조를 가지며, 제논과 플루오린 기체의 직접 반응으로 합성된다. 강력한 플루오린화 및 산화제로 유기 및 무기 화합물의 선택적 플루오린화에 사용되며, 실리콘 에칭제로도 활용된다. 또한, 다른 제논 화합물 합성에 사용되는 중요한 출발 물질이며, 용매에 잘 용해되고 유도체를 형성할 수 있다.
더 읽어볼만한 페이지
- 플루오린화물 - 헥사플루오로인산
- 플루오린화물 - 아불화 은
아불화 은은 아이오딘화 카드뮴과 결정 구조는 같지만 이온 위치가 반대이며, 은 원자 간 최단 거리는 299.6 pm이다. - 토막글 틀에 과도한 변수를 사용한 문서 - 전향
전향은 종교적 개종이나 노선 변경을 의미하며, 근대 이후 정치적 이념 변화를 지칭하는 용어로 확장되어 개인의 신념 변화, 정치적 압력 등 다양한 요인으로 발생하며, 사회주의·공산주의로부터의 전향, 전향 문학, 냉전 시대 이후의 전향 현상 등을 폭넓게 논의한다. - 토막글 틀에 과도한 변수를 사용한 문서 - 포토마스크
포토마스크는 반도체, 디스플레이, 인쇄 회로 기판 제조 시 웨이퍼에 회로 패턴을 전사하는 마스크로, 기술 발전을 거듭하며 융용 실리카 기판과 금속 흡수막을 사용하고 위상 천이 마스크, EUV 마스크 등의 고급 기술이 개발되어 반도체 미세화에 기여하고 있지만, 높은 제작 비용과 기술적 어려움은 해결해야 할 과제이다. - 토론 이름공간 토막글 - 전향
전향은 종교적 개종이나 노선 변경을 의미하며, 근대 이후 정치적 이념 변화를 지칭하는 용어로 확장되어 개인의 신념 변화, 정치적 압력 등 다양한 요인으로 발생하며, 사회주의·공산주의로부터의 전향, 전향 문학, 냉전 시대 이후의 전향 현상 등을 폭넓게 논의한다. - 토론 이름공간 토막글 - 포토마스크
포토마스크는 반도체, 디스플레이, 인쇄 회로 기판 제조 시 웨이퍼에 회로 패턴을 전사하는 마스크로, 기술 발전을 거듭하며 융용 실리카 기판과 금속 흡수막을 사용하고 위상 천이 마스크, EUV 마스크 등의 고급 기술이 개발되어 반도체 미세화에 기여하고 있지만, 높은 제작 비용과 기술적 어려움은 해결해야 할 과제이다.
2. 구조
이플루오린화 제논은 기체 상태에서 Xe-F 결합 길이가 197.73pm이고, 고체 상태에서는 200pm인 선형 분자 구조를 갖는 분자이다. 고체 XeF2의 배열은 인접한 분자의 플루오린 원자가 각 XeF2 분자의 적도 영역을 피한다는 것을 보여준다. 이는 제논 원자의 적도 영역 주위에 3쌍의 비결합 전자가 존재한다고 예측하는 VSEPR 이론의 예측과 일치한다.[17]
이플루오린화 제논은 강한 산화제 및 플루오린화제로 작용하며, 다양한 유기 및 무기 화합물과 반응한다.
높은 압력에서 이플루오린화 제논의 새로운 비분자 형태를 얻을 수 있다. ~50 GPa의 압력 하에서 XeF2는 흑연과 같이 2차원 구조로 연결된 XeF4 단위로 구성된 반도체로 변환된다. 70GPa 이상의 더 높은 압력에서는 금속성이 되어 XeF8 단위를 포함하는 3차원 구조를 형성한다.[6] 그러나 최근의 이론 연구는 이러한 실험 결과에 의문을 제기했다.[7]
Xe-F 결합은 약하다. XeF2는 총 결합 에너지가 267.8kJ/mol이며, 첫 번째 및 두 번째 결합 에너지는 각각 184.1kJ/mol 및 83.68kJ/mol이다. 그러나 XeF2는 총 결합 에너지가 92.05kJ/mol에 불과한 KrF2보다 훨씬 더 견고하다.[8]
3. 화학적 성질
오불화 브로민, 삼불화 브로민, 오불화 요오드, 무수 불화 수소, 아세토니트릴과 같은 용매에 잘 용해된다.[17] 불화 수소에서의 용해도는 29.95°C에서 100g HF 당 167g으로 높다.[17]
이플루오린화 제논(XeF2)은 금속 착물에서 리간드로 작용할 수 있다.[17] 플루오린화 수소(HF) 용액에서 다음 반응이 일어난다.
:Mg(AsF6)2 + 4 XeF2 → [Mg(XeF2)4](AsF6)2
결정학적 분석에 따르면 마그네슘 원자는 6개의 플루오린 원자와 배위되어 있다. 4개의 플루오린 원자는 4개의 이플루오린화 제논 리간드에 기인하며, 다른 두 개는 ''cis''-AsF6|AsF6-영어 리간드 쌍이다.[23] 유사한 반응으로 Mg(AsF6)2 + 2 XeF2 → [Mg(XeF2)2](AsF6)2 이 있으며, 이 생성물의 결정 구조에서 마그네슘 원자는 팔면체 배위를 이루며 XeF2 리간드는 축 방향이고, AsF6|AsF6-영어 리간드는 적도 방향이다.
M이 칼슘(Ca), 스트론튬(Sr), 바륨(Ba), 납(Pb), 은(Ag), 란타넘(La), 또는 네오디뮴(Nd)일 수 있고 A가 비소(As), 안티모니(Sb) 또는 인(P)일 수 있는 [M''x''(XeF2)''n''](AF6)''x'' 형태의 생성물과 같은 많은 반응이 관찰되었다.[24]
2004년에는 양이온 중심의 일부가 XeF2의 플루오린 원자에 의해서만 배위된 용매화물의 합성에 대한 결과가 발표되었다.[25] 반응식은 다음과 같다.
:2 Ca(AsF6)2 + 9 XeF2 → Ca2(XeF2)9(AsF6)4
이 반응은 과량의 이플루오린화 제논이 필요하다. 염의 구조는 Ca2+ 이온의 절반은 이플루오린화 제논에서 나온 플루오린 원자에 배위되고, 다른 Ca2+ 이온은 XeF2 및 AsF6|AsF6-영어 모두에 배위된다.
이플루오린화 제논은 다른 제논 화합물을 합성하는 데 사용되는 중요한 출발 물질이다. 불안정한 유기제논 화합물인 Xe(CF₃)₂영어는 육플루오로에테인을 조사(照射)하여 라디칼을 생성하고, 이 기체를 XeF₂ 위로 통과시켜 만들 수 있다. 생성된 왁스 모양의 흰색 고체는 실온에서 4시간 이내에 완전히 분해된다.[18]
XeF⁺ 양이온은 이플루오린화 제논과 과량의 액체 오플루오린화 안티몬(SbF₅)과 같은 강한 플루오린화물 수용체를 결합하여 형성된다.
: XeF₂ + SbF₅ → XeF⁺ + SbF₆⁻
이 옅은 노란색 용액에 2–3 기압의 압력으로 제논 기체를 첨가하면 상자성 Xe₂⁺ 이온을 포함하는 녹색 용액이 생성되며,[19] 이는 Xe−Xe 결합을 포함한다. ("apf"는 액체 SbF₅에서의 용액을 나타낸다.)
: 3 Xe(g) + XeF⁺(apf) + SbF₅(l) ⇄ 2 Xe₂⁺(apf) + SbF₆⁻(apf)
이 반응은 가역적이다. 용액에서 제논 기체를 제거하면 Xe₂⁺ 이온이 제논 기체와 XeF⁺로 다시 변환되고, 용액의 색상은 옅은 노란색으로 돌아온다.[20] 액체 HF가 존재하면 −30 °C에서 녹색 용액으로부터 짙은 녹색 결정을 침전시킬 수 있다.
: Xe₂⁺(apf) + 4 SbF₆⁻(apf) → Xe₂⁺[Sb₄F₂₁]⁻(s) + 3 F⁻(apf)
X선 결정학은 이 화합물의 Xe–Xe 결합 길이가 309 pm임을 나타내며, 이는 매우 약한 결합임을 시사한다.[18] Xe₂⁺ 이온은 또한 짙은 녹색인 I₂⁻ 이온과 등전자성을 나타낸다.[21][22]
3. 1. 합성
다음과 같은 간단한 반응으로 합성이 진행된다.
:Xe + F2 → XeF2
반응에는 열, 조사 또는 전기 방전이 필요하다. 생성물은 고체이며, 분별 증류 또는 진공 라인을 사용하여 선택적 응축으로 정제된다.[9]
XeF2에 대한 최초의 보고서는 1962년 10월 Chernick 등이 발표했다.[10] 그러나 이보다 늦게 발표되었지만,[11] XeF2는 1962년 초 독일 뮌스터 대학교의 루돌프 호페가 전기 방전에서 불소와 제논 가스 혼합물을 반응시켜 처음 생성했을 가능성이 높다.[12] 이 보고 직후, 아르곤 국립 연구소의 Weeks, Chernick, Matheson은 투명한 알루미나 창이 있는 모든 니켈 시스템을 사용하여 XeF2를 합성했다고 보고했는데, 여기서 동량의 제논과 불소 가스가 자외선원에 의해 조사되면 저압에서 반응하여 XeF2를 생성한다.[13] Williamson은 햇빛을 광원으로 사용하여 건조한 파이렉스 유리구에서 대기압에서도 반응이 잘 진행된다고 보고했다. 흐린 날에도 합성이 가능했다는 점이 주목할 만하다.[14]
이전의 합성에서는 불소 가스 반응물을 정제하여 플루오린화 수소를 제거했다. Šmalc와 Lutar는 이 단계를 건너뛰면 반응 속도가 원래 속도의 4배가 된다는 것을 발견했다.[15]
1965년에는 이산화이플루오린과 제논 가스를 반응시켜 합성하기도 했다.[16]
3. 2. 용해도
오불화 브로민, 삼불화 브로민, 오불화 요오드, 무수 불화 수소, 아세토니트릴과 같은 용매에 잘 용해된다.[17] 불화 수소에서의 용해도는 29.95°C에서 100 g HF 당 167 g으로 높다.[17]
3. 3. 유도체
이플루오린화 제논은 다른 제논 화합물을 합성하는 데 사용되는 중요한 출발 물질이다. 불안정한 유기제논 화합물인 Xe(CF₃)₂영어는 육플루오로에테인을 조사(照射)하여 라디칼을 생성하고, 이 기체를 XeF₂ 위로 통과시켜 만들 수 있다. 생성된 왁스 모양의 흰색 고체는 실온에서 4시간 이내에 완전히 분해된다.[18]
XeF⁺ 양이온은 이플루오린화 제논과 과량의 액체 오플루오린화 안티몬(SbF₅)과 같은 강한 플루오린화물 수용체를 결합하여 형성된다.
: XeF₂ + SbF₅ → XeF⁺ + SbF₆⁻
이 옅은 노란색 용액에 2–3 기압의 압력으로 제논 기체를 첨가하면 상자성 Xe₂⁺ 이온을 포함하는 녹색 용액이 생성되며,[19] 이는 Xe−Xe 결합을 포함한다. ("apf"는 액체 SbF₅에서의 용액을 나타낸다.)
: 3 Xe(g) + XeF⁺(apf) + SbF₅(l) ⇄ 2 Xe₂⁺(apf) + SbF₆⁻(apf)
이 반응은 가역적이다. 용액에서 제논 기체를 제거하면 Xe₂⁺ 이온이 제논 기체와 XeF⁺로 다시 변환되고, 용액의 색상은 옅은 노란색으로 돌아온다.[20]
액체 HF가 존재하면 −30 °C에서 녹색 용액으로부터 짙은 녹색 결정을 침전시킬 수 있다.
: Xe₂⁺(apf) + 4 SbF₆⁻(apf) → Xe₂⁺[Sb₄F₂₁]⁻(s) + 3 F⁻(apf)
X선 결정학은 이 화합물의 Xe–Xe 결합 길이가 309 pm임을 나타내며, 이는 매우 약한 결합임을 시사한다.[18] Xe₂⁺ 이온은 또한 짙은 녹색인 I₂⁻ 이온과 등전자성을 나타낸다.[21][22]
3. 4. 배위 화학
이플루오린화 제논(XeF2)은 금속 착물에서 리간드로 작용할 수 있다.[17] 예를 들어, 플루오린화 수소(HF) 용액에서 다음과 같은 반응이 일어난다.
:Mg(AsF6)2 + 4 XeF2 → [Mg(XeF2)4](AsF6)2
결정학적 분석에 따르면 마그네슘 원자는 6개의 플루오린 원자와 배위되어 있다. 4개의 플루오린 원자는 4개의 이플루오린화 제논 리간드에 기인하며, 다른 두 개는 ''cis''-AsF6|AsF6-영어 리간드 쌍이다.[23]
유사한 반응은 다음과 같다.
:Mg(AsF6)2 + 2 XeF2 → [Mg(XeF2)2](AsF6)2
이 생성물의 결정 구조에서 마그네슘 원자는 팔면체 배위를 이루며 XeF2 리간드는 축 방향이고, AsF6|AsF6-영어 리간드는 적도 방향이다.
M이 칼슘(Ca), 스트론튬(Sr), 바륨(Ba), 납(Pb), 은(Ag), 란타넘(La), 또는 네오디뮴(Nd)일 수 있고 A가 비소(As), 안티모니(Sb) 또는 인(P)일 수 있는 [M''x''(XeF2)''n''](AF6)''x'' 형태의 생성물과 같은 많은 반응이 관찰되었다.[24]
2004년에는 양이온 중심의 일부가 XeF2의 플루오린 원자에 의해서만 배위된 용매화물의 합성에 대한 결과가 발표되었다.[25] 반응은 다음과 같이 쓸 수 있다.
:2 Ca(AsF6)2 + 9 XeF2 → Ca2(XeF2)9(AsF6)4
이 반응은 과량의 이플루오린화 제논이 필요하다. 염의 구조는 Ca2+ 이온의 절반은 이플루오린화 제논에서 나온 플루오린 원자에 배위되고, 다른 Ca2+ 이온은 XeF2 및 AsF6|AsF6-영어 모두에 배위된다.
4. 응용
이플루오린화 제논은 유기 및 무기 화합물의 선택적 플루오린화에 사용되는 강력한 플루오린화제이자 산화제이다.[26][27] 불소 이온 수용체와 함께 사용하면 XeF+ 및 Xe2F3+와 같이 더욱 강력한 플루오린화제를 형성한다.[17]
이플루오린화 제논은 플루오린화할 원자에 대해 선택적이므로, 유기 화합물 내 다른 치환기를 건드리지 않고 헤테로 원자를 플루오린화하는 데 유용하다. 예를 들어 트라이메틸아르신 속 비소 원자는 플루오린화하지만, 메틸기는 건드리지 않는다.[31]
또한, 이플루오린화 제논은 1995년 처음 시연된 미세 전자기계 시스템(MEMS) 생산에서 실리콘의 등방성 기체 에칭제로 사용된다.[36] 상업용 시스템에서는 팽창 챔버를 이용한 펄스 에칭을 사용한다.[37] 이플루오린화 제논은 에칭 속도가 비교적 높으며, 실리콘 에칭을 위해 반응성 이온 에칭이나 외부 에너지원을 필요로 하지 않는다.
4. 1. 플루오린화제
이플루오린화 제논은 유기 화합물 및 무기 화합물의 선택적 플루오린화에 사용되는 강력한 플루오린화 및 산화제이다.[26][27] 불소 이온 수용체와 함께 사용하면 더욱 강력한 플루오린화제인 XeF+ 및 Xe2F3+ 종을 형성한다.[17]이플루오린화 제논이 관여하는 플루오린화 반응에는 다음과 같은 것들이 있다.
- '''산화 플루오린화''':
Ph3TeF + XeF2 → Ph3TeF3 + Xe
- '''환원 플루오린화''':
2 CrO2F2 + XeF2 → 2 CrOF3 + Xe +O2
- '''방향족 화합물의 플루오린화''':
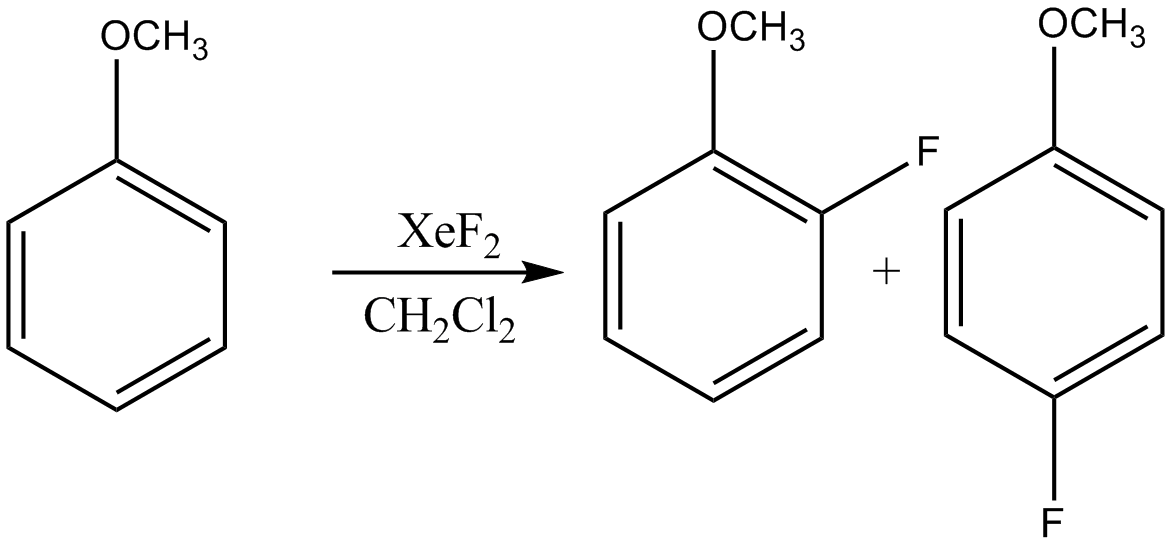
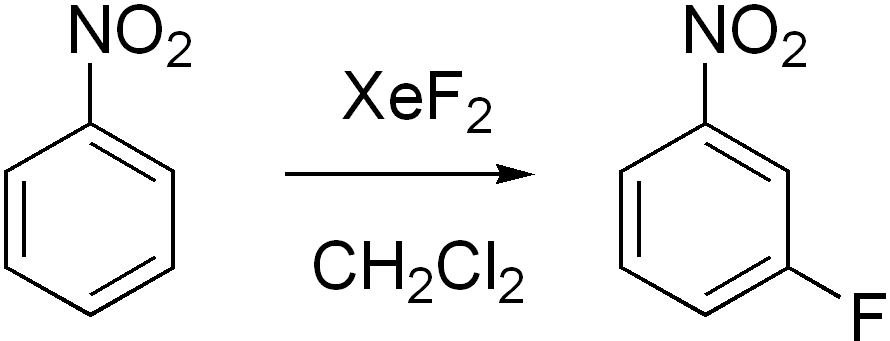
- '''알켄의 플루오린화''':
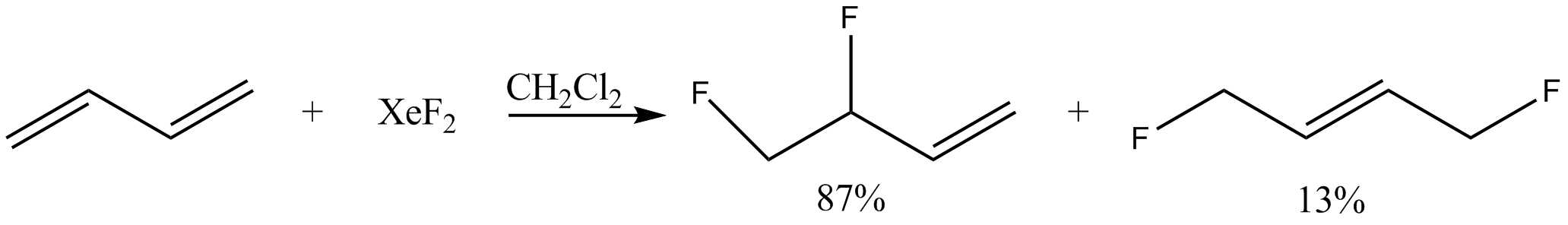
- '''라디칼 플루오린화''': 훈스디커형 반응에서 라디칼 탈카복실화 불소화 반응을 일으켜 라디칼 중간체를 생성하고 불소 전달원으로 사용된다.[28][29] 아릴 실란으로부터 아릴 라디칼을 생성하는 데에도 사용된다.[30]
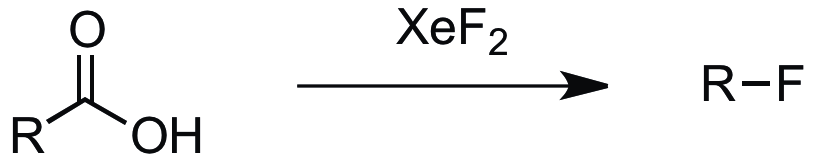
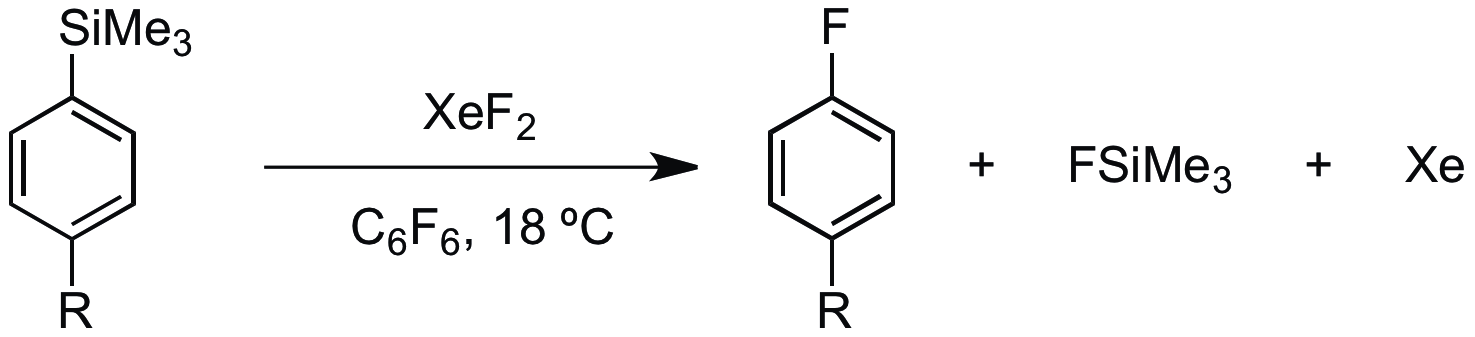
XeF2는 플루오린화할 원자에 대해 선택적이므로, 유기 화합물 내의 다른 치환기를 건드리지 않고 헤테로 원자를 플루오린화하는 데 유용하다. 예를 들어, 트라이메틸아르신 내의 비소 원자를 플루오린화하지만, 메틸기는 건드리지 않는다.[31]
:(CH3)3As + XeF2 → (CH3)3AsF2 + Xe
XeF2는 3급 아민으로부터 유기 합성에 불소 전달 시약으로 유용한 ''N''-플루오로암모늄 염(예: 셀렉트플루어)을 제조하는 데 사용될 수 있다:[32]
:[R–N+(CH2CH2)3N''':'''][BF4-] + XeF2 + NaBF4 → [R–N+(CH2CH2)3N+–F][BF4-]2 + NaF + Xe
XeF2는 카복실산을 산화적으로 탈카복실화하여 해당 플루오로알케인으로 만든다.[33][34]
:RCOOH + XeF2 → RF + CO2 + Xe + HF
사플루오린화 규소는 XeF2에 의한 플루오린화를 촉매하는 것으로 알려져 있다.[35]
4. 2. 에칭제
이플루오린화 제논은 1995년에 처음 시연된 것처럼 미세 전자기계 시스템(MEMS) 생산에서 실리콘에 대한 등방성 기체 에칭제로 사용된다.[36] 상업용 시스템은 팽창 챔버를 사용한 펄스 에칭을 사용한다.[37]Brazzle, Dokmeci 등은 이 과정을 다음과 같이 설명한다:[38]
에칭 메커니즘은 다음과 같다. 먼저 XeF2가 흡착되어 실리콘 표면에서 제논과 불소 원자로 분해된다. 불소는 실리콘 에칭 공정에서 주요 에칭제이다. XeF2와 실리콘의 반응은 다음과 같다.
:2 XeF2 + Si → 2 Xe + SiF4
XeF2는 비교적 높은 에칭 속도를 가지며 실리콘을 에칭하기 위해 반응성 이온 에칭 또는 외부 에너지원을 필요로 하지 않는다.
참조
[1]
논문
Magnetic Shielding of 19F in XeF2
[2]
서적
Chemical Principles 6th Ed.
Houghton Mifflin Company
[3]
웹사이트
Sigma Aldrich Xenon Difluoride SDS
https://www.sigmaald[...]
Millpore Sigma
2022-11-02
[4]
웹사이트
MSDS: xenon difluoride
http://www.vngas.com[...]
BOC Gases
2010-06-01
[5]
서적
Inorganic Syntheses
1966
[6]
논문
Two- and three-dimensional extended solids and metallization of compressed XeF2
[7]
논문
Freezing in Resonance Structures for Better Packing: XeF2Becomes (XeF+)(F−) at Large Compression
[8]
서적
The Chemistry of the Monatomic Gases
Elsevier Science
2013
[9]
논문
Xenon difluoride in synthesis
[10]
논문
Fluorine Compounds of Xenon and Radon
[11]
논문
Fluorination of Xenon
[12]
논문
Die Valenzverbindungen der Edelgase
[13]
논문
Photochemical Preparation of Xenon Difluoride" Photochemical Preparation of Xenon Difluoride
[14]
서적
Inorganic Syntheses
[15]
서적
Inorganic Syntheses
2007
[16]
논문
The Reaction of Xenon with Dioxygen Difluoride. A New Method for the Synthesis of Xenon Difluoride
[17]
논문
Synthesis, Properties and Chemistry of Xenon(II) Fluoride
http://acta-arhiv.ch[...]
[18]
서적
Elements of the ''p'' block
Royal Society of Chemistry, Open University
[19]
논문
The dixenon(1+) cation: formation in the condensed phases and characterization by ESR, UV-visible, and Raman spectroscopy
[20]
논문
Production of dixenon cation by reversible oxidation of xenon
[21]
서적
Introduction to modern inorganic chemistry
CRC Press
[22]
서적
Inorganic chemistry
Academic Press
[23]
논문
First Compounds of Magnesium with XeF2
[24]
논문
Atypical compounds of gases, which have been called 'noble'
Royal Society of Chemistry
2007-10-01
[25]
논문
The First Compound Containing a Metal Center in a Homoleptic Environment of XeF2 Molecules
[26]
서적
Encyclopedia of Reagents for Organic Synthesis
J. Wiley & Sons
2004
[27]
논문
Recent Advances in Electrophilic Fluorination
[28]
논문
Xenon difluoride in synthesis
[29]
논문
Fluorination of activated aromatic systems with cesium fluoroxysulfate
[30]
논문
Rapid fluorodesilylation of aryltrimethylsilanes using xenon difuoride: An efficient new route to aromatic fluorides
[31]
서적
Main group chemistry
https://archive.org/[...]
Royal Society of Chemistry
[32]
논문
Enantioselective Fluoroamination: 1,4-Addition to Conjugated Dienes Using Anionic Phase-Transfer Catalysis
2013-07-22
[33]
논문
Replacement of the carboxylic acid function with fluorine
[34]
논문
Aqueous fluorination of carboxylic acid salts
[35]
논문
Fluorination of olefins with xenon difluoride-silicon tetrafluoride
[36]
서적
Microelectronic Structures and Microelectromechanical Devices for Optical Processing and Multimedia Applications
1995
[37]
간행물
Controlled Pulse-Etching with Xenon Difluoride
1997
[38]
간행물
17th IEEE International Conference on Micro Electro Mechanical Systems. Maastricht MEMS 2004 Technical Digest
2004
[39]
논문
Photochemical Preparation of Xenon Difluoride" Photochemical Preparation of Xenon Difluoride
[40]
서적
Inorganic Syntheses
McGraw-Hill
[41]
논문
Magnetic Shielding of 19F in XeF2
[42]
논문
Synthesis, Properties and Chemistry of Xenon(II) Fluoride
http://acta-arhiv.ch[...]
[43]
서적
Chemical Principles 6th Ed.
https://archive.org/[...]
Houghton Mifflin Company
[44]
웹인용
Sigma Aldrich Xenon Difluoride SDS
https://www.sigmaald[...]
Millpore Sigma
2022-11-02
[45]
웹인용
MSDS: xenon difluoride
http://www.vngas.com[...]
BOC Gases
2010-06-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

